La bactérie Borrelia
La bactérie Borrelia est la bactérie qui provoque la borreliose de Lyme. Elle est transmise par la morsure d’une tique infectée. Cette bactérie a des caractéristiques étonnantes, preuves d’une très longue évolution.
- 1. Caractéristiques générales de la bactérie Borrelia
- 2. Comment la bactérie Borrelia échappe au système immunitaire
- 3. Résistance de Borrélia aux traitements antibiotiques classiques
- 4. Pourquoi les sérologies actuelles ne détectent que rarement l’infection
- 5. Comment Borrelia favorise sa propre dissémination
- 6. Persistance de symptômes arthritiques
- 7. Bibliographie :
I. Caractéristiques générales de la bactérie Borrelia
La bactérie Borrelia est une bactérie Gram –. Elle appartient à la classe des spirochètes, comme l’agent de la Syphilis, Treponema pallidium. Elle mesure de 20 à 30 μm de long et 0,4 μm de diamètre, ce qui la rend plutôt grande.
1. Formes
Borrelia se présente sous différentes formes dans le corps. On en connaît actuellement quatre :
- La forme caractéristique spiralée, avec paroi, qui se déplace dans les tissus, parfois le sang. C’est elle qui peut se multiplier et créer des symptômes.
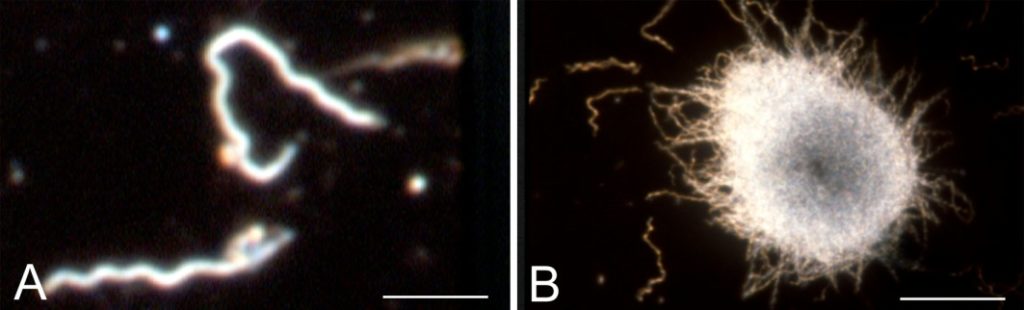
Miklossy et al, 2008
- La forme kystique, sans paroi, où la bactérie est enroulée sur elle-même, parfois à plusieurs bactéries. Elle peut rester dormante des mois, voire des années. Cette forme lui permet de résister à des conditions défavorables (notamment en présence d’antibiotique dans le milieu)
Miklossy et al, 2008
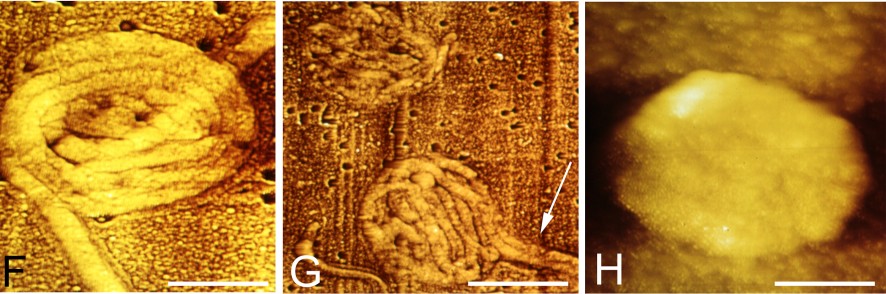
- La forme intra-cellulaire, lorsqu’elle a pénétré à l’intérieur même des cellules de l’hôte.
- La forme dans les bio-films. Récemment découverts, ces bio-films sont des amas de bactéries recouverts de fibrine.
- D’autres formes atypiques existent :
Miklossy et al, 2008
2. Classification
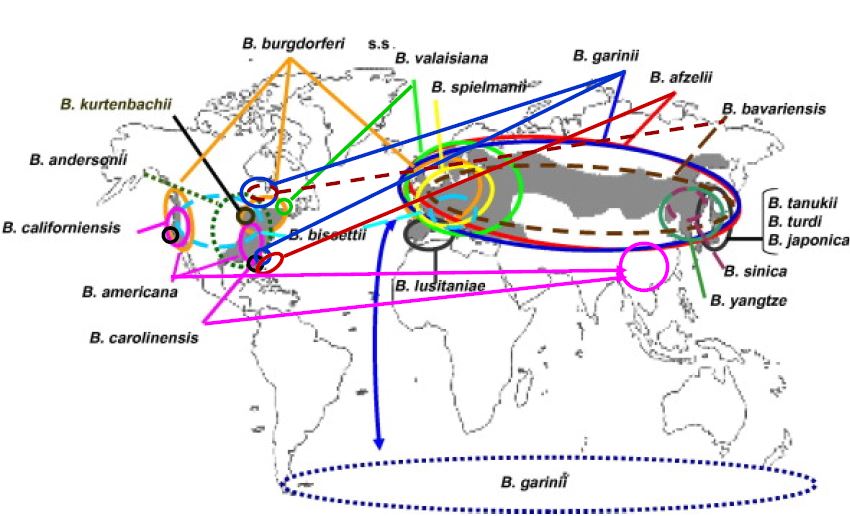
Borrelia est un genre de bactéries comprenant environ 300 souches (en évolution d’année en année).
Taxonomie de Borrelia : en page 11 et évolution de celle-ci
Parmi ces souches, certaines sont connues pour être pathogènes.
- Borrelia burgdorferi senso lato* désigne un « complexe » de plus de 20 espèces de bactéries, dont 7 sont présentes en Eurasie (Rudenko et al, 2011). Certaines sont connues comme pathogènes et présentes en France : Borrelia burgdorferi sensu stricto, B. afzelii, B. garinii et B. spielmani. Certaines, comme B. valasiana, sont présentes en France mais leur caractère pathogène n’est pas reconnu en France.
- Borrelia recurrentis et B. duttoni sont responsables des fièvres récurrentes, absentes en Europe.
* senso lato : « au sens large »
3. Carte de répartition
4. Déplacement
Borrelia a la capacité de se déplacer activement. Elle se sert de cette faculté pour se disséminer à l’intérieur de son hôte et même pour permettre son inoculation lors de la morsure par la tique et le passage dans le sang de l’hôte.
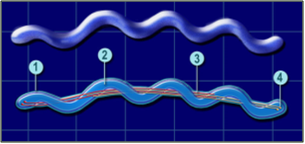
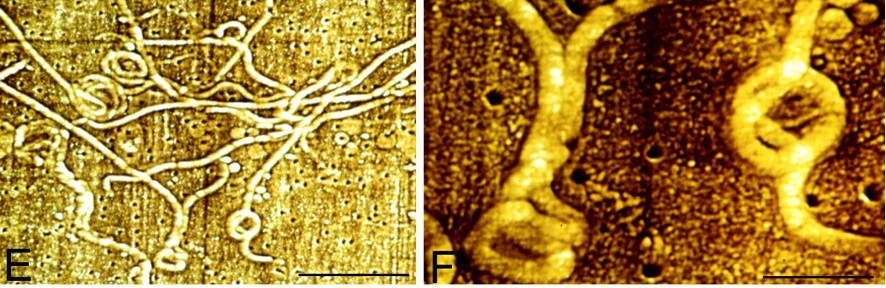
Elle possède des flagelles (3), sortes de filaments qui lui permettent de se déplacer dans les liquides ou les milieux ayant la consistance de gels.
Ces flagelles sont assez particuliers puisqu’ils sont internes ( « endo-flagelles », ou « pseudo-flagelles »). Borrelia en possède deux groupes orientés tête-bêche, ce qui lui permet de se déplacer indifféremment dans les deux sens, « en avant » comme « en arrière ».
5. Matériel génétique
L’ADN de Borrelia est remarquable et évolué. Cela pourrait expliquer son aptitude à infecter des hôtes variés, puisque en dehors de la tique et de l’homme, Borrelia peut vivre dans un large choix d’hôtes incluant des mammifères, des oiseaux, des reptiles, etc.
Ainsi :
- La bactérie possède un nombre très important de plasmides : 13 à 21 pour Borrelia burgdorferi, le plus important de toutes les bactéries (Schutzer et al. 2011).
- Le chromosome principal ainsi que certains plasmides sont linéaires, au lieu d’être circulaires comme pour la majorité des bactéries.
- 90% des gènes des plasmides sont spécifiques à Borrelia, lui apportant des fonctions spéciales.
- En tout elle possède une quantité inhabituelle d’ADN, beaucoup plus que la majorité des bactéries, dont une grande partie sous forme de plasmides. Certains gènes sont exprimés préférentiellement suivant l’hôte.
6. Multiplication
Borrelia se reproduit de la même manière que les autres bactéries, avec un moyen d’évoluer qui lui permet d’acquérir des résistances aux antibiotiques.
Elle se reproduit essentiellement par scissiparité : après avoir dupliqué son ADN, elle se scinde en deux, chaque moitié devenant une bactérie indépendante. Chaque bactérie fille est une réplique exacte de la bactérie mère. Ce mode de reproduction ne permet pas aux bactéries d’évoluer et de s’adapter aux changements de l’environnement.
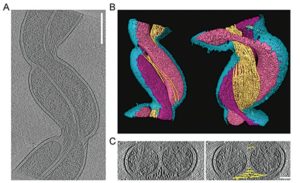
Kudryashev et al, 2011
Cependant, les bactéries disposent d’un moyen d’augmenter leur diversité génétique : la conjugaison. Ce phénomène permet un transfert de matériel génétique — via un plasmide— d’une bactérie donneuse vers une bactérie receveuse. Ce sont les plasmides qui portent la plupart des gènes de résistance aux antibiotiques. Mais ce n’est pas une caractéristique spécifique à Borrelia, toutes les bactéries la possèdent.
II. Comment la bactérie Borrelia échappe au système immunitaire
Il est désormais mondialement reconnu que la bactérie Borrelia possède des capacités de défense contre le système immunitaire de son hôte. Cela lui donne un avantage notable par rapport à d’autres bactéries moins évoluées.
1. Elle se déplace plus rapidement que les globules blancs
La bactérie Borrelia se déplace plutôt lentement dans les liquides. C’est pourquoi elle n’est pas souvent présente dans le sang.
Par contre, elle est extrêmement rapide (jusqu’à 2800 µm/min) dans les milieux à consistance de gels, dont les tissus conjonctifs qui entourent tous nos organes. Sa vitesse de déplacement y est de 10 à 100 fois supérieure à celle des globules blancs chargés de l’éliminer (30 µm/min au maximum) (polynucléaires neutrophiles et macrophages).
2. Elle se « camoufle »
La bactérie Borrelia est également capable de se camoufler de son hôte, en utilisant des molécules acceptées par le système immunitaire.
Elle est capable d’entrer à l’intérieur d’un lymphocyte et, lorsqu’elle en ressort, elle s’est couverte des antigènes de surface* du lymphocyte. En s’habillant avec les antigènes de surface propres aux cellules de son hôte, Borrelia ne peut plus être repérée par le système immunitaire et donc détruite.
* Antigènes de surface : molécules présentes à la surface des cellules, qui représentent leur « carte d’identité ». C’est grâce aux antigènes de surface que le système immunitaire reconnaît les cellules qui font partie de notre corps, et les distingue des cellules étrangères.
Par ailleurs, Borrelia utilise une protéine (Salp15) présente dans la salive de la tique pour faciliter l’invasion de l’ hôte vertébré. Le taux de cette protéine chez la tique est augmenté quand la tique est infectée, et les Borrelia se montrent capables (in vitro et in vivo) de s’enduire de cette protéine pour se protéger des lymphocytes (Rosa, 2005).
3. Elle détruit activement les lymphocytes
Lors de longues infections par Borrelia, après plusieurs mois ou années (borréliose chronique), le taux de certains lymphocytes diminue drastiquement. Il est probable que Borrelia tue activement ces lymphocytes, comme le virus du SIDA s’attaque à un type de lymphocytes, les T4.
4. Elle leurre le système immunitaire et l’amène à attaquer ses propres cellules
Les malades de Lyme sont sujets à des maladies auto-immunes, ou du moins à des symptômes évocateurs qui conduisent à des diagnostics de maladies auto-immunes : lupus érythémateux, polyarthrite rhumatoïde, sclérose en plaques, thyroïdite de Hashimoto, etc. D’ailleurs, Borrelia burgdorferi a été découverte en 1982, suite à une investigation à propos d’une épidémie d’arthrite rhumatoïde. Les mécanismes par lesquels Borrelia amène le système immunitaire à se tromper de cible et à attaquer les cellules propres à l’organisme sont encore en cours d’étude.
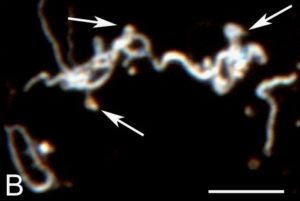
Miklossy et al, 2008
Un mécanisme possible est la libération par les Borrelia de petites vésicules comprenant une membrane et des fragments d’ADN bactérien, appelées liposomes, ou plus couramment « blebs ». Ces vésicules ont la faculté de pénétrer jusqu’au noyau des cellules de l’hôte, où l’ADN bactérien pourrait s’incorporer à l’ADN des cellules humaines. Cela ressemble beaucoup à ce qui se passe avec les virus.
Ces cellules recevant l’ADN bactérien sont appelées cellules « transfectées » plutôt qu’infectées, car elles ne contiennent pas des bactéries Borrelia entières mais seulement des fragments de leur ADN. Mais ces cellules transfectées deviendraient la cible de notre système immunitaire, puisqu’elles expriment des antigènes de surface de Borrelia (Lawrence et al. 1995). Ce pourrait être la cause de nombreux symptômes de la maladie de Lyme chronique et des phénomènes d’auto-immunité en particulier (Whitmire et Garon, 1993).
5. Elle provoque une inflammation disproportionnée
Borrelia amène le système immunitaire de son hôte à se tromper de cible, en larguant derrière elle des myriades de vésicules « leurres », exactement comme les leurres que les sous-marins lâchent derrière eux pour dévier les torpilles ennemies.
Les blebs (voir ci-dessus), avant de s’incorporer à d’autres cellules, sont également la cible du système immunitaire car leurs membranes contiennent des antigènes de surface (protéines) qui provoquent une intense réaction immunitaire ; les OSPA, B, et C (Outer Surface Protein). Comme ces blebs sont très nombreux, ils affolent le système immunitaire et sont en partie responsables de l’inflammation chronique des malades de Lyme, avec libération massive de cytokines inflammatoires. Mais pendant que le système immunitaire s’épuise à détruire ces blebs inoffensifs, les bactéries réelles se promènent dans les tissus conjonctifs sans être inquiétées… (Whitmire et Garon, 1993).
III. Résistance de Borrélia aux traitements antibiotiques classiques
Le traitement « standard » de la maladie de Lyme est de 2 à 4 semaines d’antibiotiques. S’il peut suffire dans le premier stade (érythème migrant), il est bien insuffisant lorsque la bactérie s’est disséminée dans le corps. De nombreux travaux scientifiques ont démontré la persistance de Borrelia dans le corps malgré des mois de traitements antibiotiques.
Comment cette bactérie arrive-t-elle à survivre malgré un traitement antibiotique suffisant pour d’autres bactéries ?
Ces facteurs pourraient — au moins en partie — expliquer des réinfections fréquemment récurrentes avec les spirochètes, et le caractère souvent récurrent des symptômes entrecoupés de phase de dormance apparente du microbe
1. Elle se divise très lentement
Les antibiotiques de type pénicilline (amoxicilline), utilisés couramment pour traiter une maladie de Lyme, agissent au moment de la division cellulaire : au lieu de se diviser en deux, la bactérie éclate et meurt. Ils ne peuvent donc agir que sur les formes actives en train de se multiplier. Borrelia a la particularité de se diviser extrêmement lentement : une à deux divisions par 24h, alors que d’autres bactéries comme Escherichia coli se multiplie 3 fois par heure, c’est-à-dire 36 à 72 fois plus vite. Ceci explique pourquoi les traitements doivent être beaucoup plus longs pour couvrir le même nombre de cycles de reproduction qu’avec d’autres bactéries.
C’est pourquoi les 2 à 4 semaines de traitement classiques en France sont considérées comme insuffisantes par beaucoup de médecins spécialistes, qui recommandent 3 à 4 semaines après la disparition des symptômes.
2. Elle change de forme
Comme vu précédemment, Borrelia peut se présenter sous différentes formes suivant les conditions. Elle peut changer de forme en présence d’un antibiotique, se transformer en kyste où elle reste en dormance jusqu’à ce que le milieu ne lui soit plus défavorable.
Les antibiotiques de type pénicilline et les céphalosporines ne peuvent attaquer que la forme spiralée, avec paroi. Pour attaquer les autres formes, il faut d’autres antibiotiques.
- Certains seront utilisés pour les formes intra-cellulaires : macrolides, quinolones, tétracyclines.
- D’autres contre les formes kystiques : metronidazole, hydroxychloroquine.
- Dans les bio-films, les antibiotiques pénètrent mal. Il faut lyser la membrane du bio-film avec par exemple de la serrapeptase ou de l’extrait de pépin de pamplemousse.
Les médecins connaisseurs de Lyme traitent avec des combinaisons de plusieurs antibiotiques. Pour éviter les interactions et les effets secondaires, alternent les molécules par rotation. Ils réalisent également des thérapies pulsées : alternance de prise et d’arrêt, à des rythmes variables.
De plus, comme toutes les bactéries, Borrelia peut développer des résistances aux antibiotiques.
IV. Pourquoi les sérologies actuelles ne détectent que rarement l’infection
Les tests de laboratoire (« la biologie ») sont classiquement utilisés en médecine pour détecter et diagnostiquer des infections. Cependant, pour la borréliose, les caractéristiques de la bactérie font que les tests actuels se révèlent souvent inefficaces.
1. Multiplicité et variété des souches de Borrelia
Comme dit précédemment, il existe de très nombreuses souches du groupe B. burgdorferi sensu lato rien qu’en Europe : Borrelia azfelli, gariniii, spielmanii, lusitanii, valaisiana…
Actuellement, la sérologie ELISA utilisée en France est préparée avec des protéines chimères recombinantes* et ne détecte que certaines souches pathologiques de la borréliose : sensu stricto, afzelii et garinii. En cas d’infection par un ou plusieurs autres souches, le test ne les détectera pas et reviendra négatif.
* principal test utilisé : Vidas Lyme Biomérieux
2. La Borrelia affaiblissant le système immunitaire, peut empêcher la formation d’anticorps
Les tests utilisés classiquement (ELISA et Western Blot) ne détectent pas la bactérie elle-même mais les anticorps dirigés contre elle, que le corps fabrique…
Or, Borrelia attaque le système immunitaire : elle l’affaiblit notablement. Souvent les malades chroniques ne fabriquent pas assez d’anticorps et ne sont pas dépistés par les tests classiques (ELISA, Western Blot).
3. Elle peut envahir tous les organes mais pas tous en même temps…
Borrelia ne reste pas fréquemment dans le sang, elle est plus présente dans les tissus conjonctifs. Elle se déplace, d’où le caractère migrant des symptômes.
Pour réaliser un test PCR, qui recherche l’ADN de Borrelia, il faut choisir le lieu de prélèvement mais cela ne correspond pas toujours à la zone où la bactérie est présente.
V. Comment Borrelia favorise sa propre dissémination
1. Adaptation de Borrelia à la transmission par morsures
Les Borrelia sont transmises essentiellement par des piqûres de tiques. Ce mode de propagation nécessite une adaptation très poussée de la bactérie.
Elle est disséminée dans tous les organes de l’animal infecté, et en faible quantité dans le sang… Si une tique absorbe de ce sang en piquant l’animal, la Borrelia se retrouve dans le tube digestif de la tique. Elle résiste aux sucs digestifs de la tique. Elle s’installe dans le système digestif sous forme dormante.
Ce n’est que lors d’un prochain repas de sang, donc souvent après une mue de la tique, et un délai qui peut durer plusieurs mois, qu’elle va se réveiller. Lorsque le sang de ce nouveau repas afflue dans le tube digestif de la tique, la Borrelia sort de sa dormance et se déplace jusqu’aux glandes salivaires de la tique, par où elle est injectée, avec la salive, dans la circulation sanguine de son nouvel hôte.
Il s’agit d’un mode de transmission très complexe : la Borrelia est active et s’adapte aux conditions de son environnement. Elle va elle-même se placer, au moment opportun, à l’endroit précis du corps de la tique où elle doit se trouver pour être injectée…
2. Mécanisme de facilitation
La Borrelia modifie le métabolisme des tiques, en leur augmentant leur stockage de graisse : les tiques infectées par Borrelia ont une plus forte masse graisseuse en proportion de leur taille que les autres. Cette caractéristique leur permet de rester plus longtemps à l’affût, dans l’attente d’un hôte, d’avoir moins besoin de se réhydrater et donc de se déplacer davantage dans des conditions de sécheresse par rapport aux autres. Elles ont donc une meilleure chance de trouver un hôte et de s’y nourrir, et de transmettre la Borrelia en même temps.
Ce type de mécanisme, où le parasite modifie son hôte pour lui permettre de mieux se disséminer, s’appelle la facilitation, rencontrée chez de nombreux parasites.
Voir aussi : http://jb.asm.org/cgi/content/full/183/16/4771
VI. Persistance de symptômes arthritiques
L’existence d’un peptidoglycane (constituant de paroi cellulaire de la bactérie) après un traitement par antibiotique bien conduit et surtout sa persistance dans les articulations pourraient expliquer la chronicité de symptômes sur les articulations.
Source : https://www.pnas.org/content/116/27/13498
VII. Bibliographie :
- Casjens, Sherwood, et al. 2000. A bacterial genome in flux: the twelve linear and nine circular extrachromasomal DNAs in an infectious isolate of the Lyme disease spirochete Borrelia burdorferi. Molecular Microbiology, 35: 490-516. Lien
- Fraser, Claire M. et al. 1997. Genomic sequence of a Lyme disease spirochaete, Borrelia burgdorferi. Nature, vol. 390: 580-586. Lien
- A Grankvist et al. Clin Infect Dis 58 (12), 1716-1722. 2014 Mar 18. Infections With the Tick-Borne Bacterium « Candidatus Neoehrlichia Mikurensis » Mimic Noninfectious Conditions in Patients With B Cell Malignancies or Autoimmune Diseases
- Lawrence C, Lipton RB, Lowy FD, Coyle PK, 1995. Seronegative chronic relapsing neuroborreliosis. Eur Neurol 1995;35(2):113-117. Lien
Rosa P, 2005. « Lyme disease agent borrows a practical coat » Nat. Med. 2005;11:831-832 DOI:10.1038/nm0805-831 Lien - Schutzer, S. E., et al. 2011. Whole genome sequences of thirteen isolates of Borrelia burgdorferi. J. Bacteriol. 193:1018-1020. Lien
- Whitmire WM, Garon, 1993. CF: Specific and nonspecific responses of murine B cells to membrane blebs of Borrelia burgdorferi. Infect Immun 1993; 61: 1460-1467. Lien
- Images : Miklossy et al. Journal of Neuroinflammation 2008 5:40 doi:10.1186/1742-2094-5-40 Lien
- Borrelia burgdorferi peptidoglycan is a persistent antigen in patients with Lyme arthritis PNAS July 2, 2019 116 (27) 13498-13507; first published June 17, 2019 Lien
